Sacs de solution intraveineuse de Baxter – Fuite potentielle pendant la perforation de l’orifice d'administration
Résumé
Voir les messages clés ci-dessous
Produits visés
| Nom du produit | Format | Code de produit | Titulaire de l’autorisation de mise en marché | DIN | Numéros de lot/dates de péremption des produits non rappelés |
|---|---|---|---|---|---|
| Lidocaïne à 0,4 % et Dextrose à 5 % injectable | 250 mL | JB0972 | Corporation Baxter | 00828602 | Voir l'annexe A |
| Chlorure de sodium à 0,9 % injectable, USP | 100 mL 250 mL | JB1302 JB1322 | Corporation Baxter | 00060208 | Voir l'annexe A |
| Lactate de Ringer injectable, USP | 250 mL | JB2322 | Corporation Baxter | 00061085 | Voir l'annexe A |
| Métronidazole injectable, USP | 100 mL | JB3415 | Corporation Baxter | 00870420 | Voir l'annexe A |
Problème
Les sacs intraveineux de Baxter de Lidocaïne à 0,4 % et Dextrose à 5 % injectable 250 mL, Chlorure de sodium à 0,9 % injectable, USP 100 mL et 250 mL, Lactate de Ringer injectable, USP 250 mL, et Métronidazole injectable, USP 100 mL de certains lots présentent un risque de fuite pendant le processus de perforation de l’orifice d’administration.
Les lots touchés identifiés à l'annexe A ne font pas l'objet d'un rappel pour le moment afin d'éviter une pénurie de ces produits médicalement nécessaires.
Destinataires
Professionnels de la santé, y compris les médecins, les infirmières, les pharmaciens et d'autres membres du personnel médical et de soutien, y compris la gestion des stocks et les agences de soins de santé à domicile impliquées dans l'administration et la manipulation des produits Baxter suivants :
- LIDOCAÏNE À 0,4 % ET DEXTROSE À 5 % INJECTABLE (250 ML)
- CHLORURE DE SODIUM À 0,9 % INJECTABLE, USP (100 mL et 250 mL)
- LACTATE DE RINGER INJECTABLE, USP (250 mL)
- MÉTRONIDAZOLE INJECTABLE, USP (100 mL)
Messages clés
- Certains lots de sacs de solution intraveineuse de Baxter présentent un risque de fuite pendant le processus de perforation de l’orifice d’administration.
- Il est conseillé aux professionnels de la santé de :
- NE PAS utiliser le produit si le défaut est observé.
- Suivre les conseils sur la manipulation et la vérification des produits touchés (voir la section « Renseignements à l’intention des professionnels de la santé ») et
- Assurer la préparation aux points d'utilisation où les produits touchés sont identifiés.
- Évitez d'utiliser les lots touchés lorsque cela est possible, en particulier dans les situations nécessitant une utilisation immédiate du produit (p. ex. salle d'opération, soins intensifs et service d’urgence). Si seuls les produits des lots touchés sont disponibles, des mesures supplémentaires devraient être envisagées, y compris l'approvisionnement immédiat de sacs de remplacement au point d'utilisation et des mesures de sécurité supplémentaires fondées sur la pratique professionnelle.
Contexte
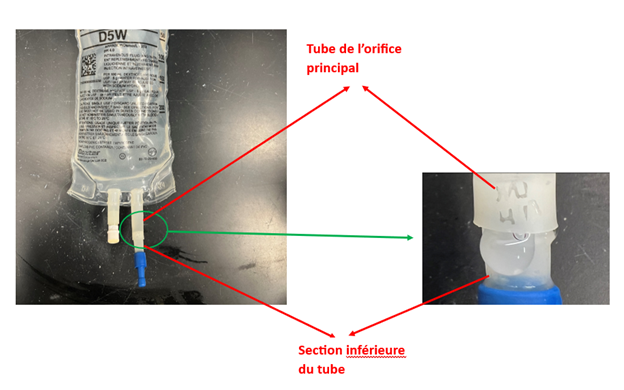
Il y a eu des rapports de fuites et/ou de débranchements observés lors de la perforation de l'orifice d'administration au raccordement de la section inférieure du tube et du tube de l'orifice principal (voir l'annexe B à titre d'exemple).
Baxter a identifié la cause de la fuite de ces sacs intraveineux comme une combinaison de facteurs liés au processus de fabrication. Baxter a mis en œuvre des mesures appropriées pour traiter les fuites et éviter que cette situation se produise à nouveau.
Les produits des lots touchés ont été distribués par Corporation Baxter au Canada à compter du 28 avril 2023.
Les risques pour la sécurité qui pourraient survenir en raison d'une fuite d’un sac de solution comprennent les suivants :
- Retard ou interruption du traitement entraînant l'administration d'une dose inexacte.
- Les professionnels de la santé ou les patients courent un risque d’être exposés au produit pharmaceutique, y compris les médicaments dangereux (p. ex. les agents chimiothérapeutiques cytotoxiques) lorsque ces médicaments ont été ajoutés aux sacs.
- Les patients peuvent recevoir une perfusion de solution contaminée en raison de la contamination microbienne de la solution au point d'utilisation.
- Les professionnels de la santé ou les patients courent un risque d’être exposés à des dangers en raison de la fuite de solution sur l'équipement électrique.
Baxter adopte une approche de rappel progressif pour prévenir une pénurie de produits. En consultation avec Santé Canada, les lots touchés identifiés à l'annexe A ne font pas l'objet d'un rappel pour le moment afin d'assurer la disponibilité continue de ces produits médicalement nécessaires. D'autres mesures du marché pourraient être prises à l'avenir une fois qu'il y aura suffisamment d'approvisionnement non touché.
Baxter a déjà émis des rappels similaires de produits touchés par ce problème, en consultation avec Santé Canada. Pour obtenir de plus amples renseignements, veuillez consulter la Base de données sur les rappels et les avis de sécurité sur le site Web Canadiens en santé.
Renseignements à l’intention des consommateurs (patients à domicile)
N'utilisez PAS les sacs des lots touchés si vous constatez des dommages ou des fuites de liquide.
Si vous constatez une fuite de liquide des sacs avant ou pendant le traitement, arrêtez d'utiliser le produit, car il pourrait y avoir un risque de préjudice, et consultez votre professionnel de la santé.
Il faut porter des gants lors de la manipulation du sac afin d'éviter toute exposition à des médicaments cytotoxiques (comme certains médicaments anticancéreux) qui auraient pu être ajoutés au liquide dans les sacs.
Consultez votre professionnel de la santé si vous avez utilisé un produit provenant d'un lot touché, ou si vous n'êtes pas sûr et si vous avez des questions ou des préoccupations au sujet de votre santé.
Renseignements à l’intention des professionnels de la santé
- Inspectez visuellement le contenant. Si le l’orifice d'administration est endommagé, détaché ou non présent, jeter le contenant, car la stérilité de la solution pourrait être compromise.
- Vérifiez s'il y a des fuites au niveau de l’orifice d'administration après avoir perforé le sac, en appliquant une légère pression près du port d'administration. Si des fuites sont décelées, jeter la solution, car la stérilité pourrait être compromise.
- En raison de la possibilité qu'une fuite au niveau de l'orifice ne soit pas immédiatement observée, attendez 1-2 minutes avant d'ajouter des médicaments.
- Au cours de la préparation des médicaments cytotoxiques, suivez les normes de pratique de la pharmacie et considérez :
- Perforez le sac en premier avec le dispositif d'administration ou le perforateur CSTD (dispositif de transfert de système fermé) du sac
- Inspectez le sac avant d'ajouter le médicament
- Mélangez le médicament après avoir perforé le sac
- Après avoir ajouté le médicament, laissez le sac suspendu sous la hotte pendant 1-2 minutes supplémentaires avant de l'envoyer aux unités pour vous assurer qu'il n'y a pas de fuite
- Surveillez régulièrement pour déceler toutes fuites du sac pendant le traitement et cessez l'utilisation si une fuite est observée.
- S'assurer que les trousses de nettoyage des déversements sont facilement disponibles dans l'unité lors de l'administration de médicaments cytotoxiques et que le personnel est préparé, formé et au courant de la façon de gérer et de manipuler les matières dangereuses
- Des gants doivent être portés lors de la manipulation des sacs afin d'éviter toute exposition à des médicaments dangereux qui auraient pu être ajoutés aux sacs
- Dans la mesure du possible, évitez d'utiliser les lots concernés des solutions intraveineuses de Baxter, en particulier dans les situations nécessitant une utilisation immédiate du produit (p. ex. salle d'opération, soins intensifs et service d’urgence). Si seuls les produits des lots concernés sont disponibles, des mesures supplémentaires devraient être envisagées, y compris l'approvisionnement immédiat de sacs de remplacement au point d'utilisation et des mesures de sécurité supplémentaires fondées sur la pratique professionnelle.
Mesures prises par Santé Canada
Santé Canada communique ces renseignements importants sur l’innocuité aux professionnels de la santé et aux Canadiens au moyen de la Base de données sur les rappels et les avis de sécurité sur le site Web Canadiens en santé. Cette communication sera ensuite diffusée par le système de notification électronique MedEffect™ par courriel.
Santé Canada a demandé à Corporation Baxter, titulaire de l'autorisation de mise en marché pour Lidocaïne à 0,4 % et Dextrose à 5 % injectable 250 mL, Chlorure de sodium à 0,9 % injectable, USP 100 mL et 250 mL, Lactate de Ringer injectable, USP 250 mL, et Métronidazole injectable, USP 100 mL, de s'assurer qu'ils informent tous les professionnels de la santé concernés, les patients et le personnel qui administrent ou manipulent ces produits.
Santé Canada surveille la mise en œuvre par l'entreprise de toute mesure corrective et préventive supplémentaire. Si d'autres renseignements sur l'innocuité sont trouvés, Santé Canada prendra les mesures appropriées et informera les Canadiens au besoin.
Signaler un problème lié à la santé ou à l’innocuité
La capacité de Santé Canada de surveiller l'innocuité des produits de santé commercialisés dépend de la déclaration par les professionnels de la santé et les consommateurs d'effets indésirables et d'incidents liés aux instruments médicaux. Tout effet indésirable grave ou inattendu chez les patients recevant Lidocaïne à 0,4 % et Dextrose à 5 % injectable 250 mL, Chlorure de sodium à 0,9 % injectable, USP 100 mL et 250 mL, Lactate de Ringer injectable, USP 250 mL, et Métronidazole injectable, USP 100 mL doit être signalé à Corporation Baxter ou à Santé Canada.
Corporation Baxter
7125 Mississauga Road
Mississauga (Ontario) L5N 0C2
Pour corriger votre adresse postale ou numéro de télécopieur, communiquez avec Corporation Baxter par courriel au fca_canada@baxter.com.
Vous pouvez signaler les effets secondaires soupçonnés associés à l’utilisation de produits de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirables en ligne, par courrier ou par télécopieur.
Pour d’autres renseignements concernant les produits de santé liés à cette communication, veuillez communiquer avec Santé Canada à :
Direction de la conformité des produits de santé, Direction générale des opérations réglementaires et de l'application de la loi
Courriel : hpce-cpsal@hc-sc.gc.ca
Téléphone : 1-800-267-9675
Original signé par,
Brandon Gingrich
Directeur principal, Qualité
Corporation Baxter – Canada
Annexe A : Lots touchés NON sujets au rappel
| Code de produit | Description du produit | Numéro de lot | Date d'expiration | DIN |
|---|---|---|---|---|
|
JB0972 (JB0972) |
0.4% LIDOCAINE & 5% DEXTROSE INJECTION (250ML) |
W3E11C1 | AOÛT 2024 | 00828602 |
|
JB2322 (JB2322P) |
LACTATED RINGER'S INJECTION, USP (250 ML) |
W3F22C1 | SEPT. 2024 | 00061085 |
| JB3415 | METRONIDAZOLE INJECTION, 500 mg / 100 mL, USP (100ML) |
W3E30C1 | NOV. 2024 | 00870420 |
|
JB1302 (JB1302P) |
0.9% SODIUM CHLORIDE INJECTION, USP (100 ML) |
W3D25C0 |
AVR 2024 |
00060208 |
| W3D26C0 | AVR 2024 | |||
| W3D29C2 | AVR 2024 | |||
| W3E03C0 | MAI 2024 | |||
| W3E04C0 | MAI 2024 | |||
| W3E09C0 | MAI 2024 | |||
| W3E18C0 | MAI 2024 | |||
| W3E30C0 | MAI 2024 | |||
| W3F06C0 | JUIN 2024 | |||
| W3F13C0 | JUIN 2024 | |||
| W3F21C0 | JUIN 2024 | |||
| W3F28C0 | JUIN 2024 | |||
| W3F29C0 | JUIN 2024 | |||
| W3G11C0 | JUILL. 2024 | |||
| W3G12C0 | JUILL. 2024 | |||
| W3G13C0 | JUILL. 2024 | |||
| W3G17C3 | JUILL. 2024 | |||
| W3G18C0 | JUILL. 2024 | |||
|
JB1322 (JB1322P) |
0.9% SODIUM CHLORIDE INJECTION, USP (250 ML) |
W3D24B0 | JUILL. 2024 | 00060208 |
| W3D27C0 | JUILL. 2024 | |||
| W3E01B0 | AOÛT 2024 | |||
| W3E02B0 | AOÛT 2024 | |||
| W3E05C1 | AOÛT 2024 | |||
| W3E10B0 | AOÛT 2024 | |||
| W3E13C1 | AOÛT 2024 | |||
| W3E15B1 | AOÛT 2024 | |||
| W3E16B0 | AOÛT 2024 | |||
| W3E25C2 | AOÛT 2024 | |||
| W3F01C0 | SEPT. 2024 | |||
| W3F01C0S | SEPT. 2024 | |||
| W3F02C1 | SEPT. 2024 | |||
| W3F05B0 | SEPT. 2024 | |||
| W3F12B0 | SEPT. 2024 | |||
| W3F14C0 | SEPT. 2024 | |||
| W3F16B0 | SEPT. 2024 | |||
| W3F19B0 | SEPT. 2024 | |||
| W3F20B0 | SEPT. 2024 | |||
| W3F21B0KX | SEPT. 2024 | |||
| W3F21B0X | SEPT. 2024 | |||
| W3F22C0 | SEPT. 2024 | |||
| W3F30C0 | SEPT. 2024 | |||
| W3G10B0 | OCT. 2024 | |||
| W3G11B0 | OCT. 2024 | |||
| W3G12B0K | OCT. 2024 | |||
| W3G12B0X | OCT. 2024 | |||
| W3G14C0 | OCT. 2024 | |||
| W3G15C0 | OCT. 2024 | |||
| W3G17B0 | OCT. 2024 | |||
| W3G17B0S | OCT. 2024 | |||
| W3G18B0 | OCT. 2024 | |||
| W3G18B0S | OCT. 2024 |
Annexe B :
La photo suivante est un exemple de l'endroit où les fuites peuvent se produire pour les lots en cause :
Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des courriels concernant les nouveaux rappels et avis de sécurité, ainsi que leurs mises à jour.