Cette page Web a été archivée dans le Web
L’information dont il est indiqué qu’elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n’est pas assujettie aux normes Web du gouvernement du Canada et elle n’a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Risperdal Consta (rispéridone poudre pour suspension injectable à libération prolongée) - Cas de séparation d'aiguille associés à l'assemblage de l'aiguille utilisée pour l'injection dans le muscle fessier
- Date de début :
- 7 avril 2010
- Date d’affichage :
- 25 mai 2010
- Type de communication :
- Avis aux professionnels de la santé
- Sous-catégorie :
- Médicaments
- Source :
- Santé Canada
- Problème :
- Aides fonctionnelles et matériels médicaux, Sécurité des produits
- Public :
- Professionnels de la santé
- Numéro d’identification :
- RA-170002354
La présente est une copie d'une lettre de Janssen-Ortho Inc.
Veuillez communiquer avec la compagnie pour obtenir copie de toute référence, pièce jointe ou annexe.
Renseignements importants au sujets des avis de Santé Canada
Le 7 avril 2010
Aux professionnels de la santé :
Objet : Cas de séparation d'aiguille associés à l'assemblage de l'aiguille utilisée pour l'injection dans le muscle fessier de Risperdal® Consta® rispéridone poudre pour suspension injectable à libération prolongée
Janssen-Ortho, en collaboration avec Santé Canada, désire vous communiquer des renseignements importants concernant des cas de séparation de l'aiguille utilisée pour l'injection de Risperdal® Consta® (rispéridone) dans le muscle fessier.
Il est important de noter que le médicament même, soit la poudre composée de microsphères de rispéridone et le solvant fourni pour la reconstitution, ne sont pas affectés par l'assemblage de l'aiguille ou sa séparation.
- Janssen-Ortho a reçu des rapports de séparation de l'aiguille utilisée avec Risperdal® Consta®. La séparation de l'aiguille peut survenir lors de l'assemblage, avant l'injection, pendant l'injection ou lors de l'élimination de la seringue.
- Cette séparation pourrait potentiellement causer une piqûre d'aiguille accidentelle ou l'injection incomplète du médicament.
- Pour une administration réussie de Risperdal® Consta® on doit suivre attentivement, étape par étape, le mode d'emploi. Après avoir suivi le mode d'emploi fourni avec le produit et avant de passer à l'injection, Janssen-Ortho recommande aux professionnels de la santé de vérifier à nouveau la connexion entre la seringue et le dispositif de sécurité Needle-Pro® de couleur orange afin de confirmer que le dispositif est bien fixé.
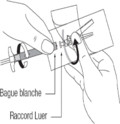
Illustration du raccordement
On a constaté une augmentation récente des cas signalés de difficultés à fixer le dispositif de sécurité Needle-Pro® de couleur orange, muni de l'aiguille de 2 pouces pour injection dans le muscle fessier, sur le raccord Luer de la seringue fournie dans le nécessaire d'injection Risperdal® Consta®. Dans certains cas, le dispositif de sécurité Needle-Pro® de couleur orange « revient en sens inverse » après la connexion au raccord Luer (bague blanche) de la seringue.
Janssen-Ortho a reçu 83 réclamations liées à la séparation de l'aiguille au cours des trois derniers mois. Ce nombre représente une proportion de une plainte pour 660 unités vendues. Parmi ces 83 cas, cinq ont signalé une administration manquée ou incomplète de la dose, ce qui représente un cas pour 11 500 unités vendues. L'analyse de l'origine de ce problème est en cours. Des améliorations au niveau de la fabrication ont été identifiées et s'acheminent le plus rapidement possible vers la mise en oeuvre.
Recommandations
Pour une administration réussie de Risperdal® Consta®, on doit suivre attentivement, étape par étape, le mode d'emploi. Après avoir suivi le mode d'emploi fourni avec le produit et avant de passer à l'injection, Janssen-Ortho recommande aux professionnels de la santé de vérifier à nouveau la connexion entre la seringue et le dispositif de sécurité Needle-Pro® de couleur orange afin de confirmer que le dispositif est bien fixé. Il est conseillé aux cliniciens de gérer au cas par cas les situations individuelles de doses manquées ou partiellement administrées.
Veuillez signaler immédiatement à Janssen-Ortho toute séparation de l'aiguille. Dans les cas où la séparation de l'aiguille rend impossible l'administration du médicament, Janssen-Ortho remplacera le nécessaire d'injection sans frais.
Risperdal® Consta® (rispéridone) est indiqué pour le traitement des manifestations de la schizophrénie et des troubles psychotiques apparentés. Risperdal® Consta® est également indiqué en monothérapie comme traitement d'entretien chez les patients atteints d'un trouble bipolaire de type 1, ayant déjà répondu à des antipsychotiques oraux ou à un autre traitement antimaniaque, afin de retarder la survenue d'épisode maniaque.
La gestion des effets indésirables liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Les taux de déclaration calculés à partir des effets indésirables signalés de façon spontanée après commercialisation des produits de santé sous-estiment généralement les risques associés aux traitements avec ces produits de santé. Tout cas de séparation d'une aiguille, de piqûre d'aiguille accidentelle, d'injection incomplète de Risperdal® Consta® ou tout autre effet indésirable doit être signalé à Janssen-Ortho ou à Santé Canada (pour les effets indésirables graves ou inattendus), aux adresses suivantes :
Janssen-Ortho Inc.
Service de l'information médicale
19 Green Belt Drive
Toronto (Ontario) M3C 1L9
Téléphone : 1-800-567-3331
Télécopieur : 416-449-5248
MedinfoCanada@joica.jnj.com
Tout effet indésirable présumé peut aussi être déclaré au :
Programme Canada Vigilance
Direction des produits de santé commercialisés
Santé Canada
Indice de l'adresse : 0701E
Ottawa (Ontario) K1A 0K9
Téléphone : 613-957-0337 ou télécopieur : 613-957-0335
CanadaVigilance@hc-sc.gc.ca
Pour déclarer un effet indésirable, les consommateurs et les professionnels de la santé peuvent composer ces lignes sans frais :
Téléphone : 1-866-234-2345 ou télécopieur : 1-866-678-6789
Les étiquettes préaffranchies, les formulaires de déclaration de Canada Vigilance ainsi que les lignes directrices concernant la déclaration d'effets indésirables sont disponibles sur le site Web de MedEffetMC Canada à la section Déclaration des effets indésirables. Le formulaire de déclaration est aussi dans le Compendium canadien des produits et des spécialités pharmaceutiques.
Pour d'autres renseignements concernant les produits de santé reliés à cette communication, veuillez communiquer avec Santé Canada à :
Direction des produits de santé commercialisés (DPSC)
Courriel : mhpd_dpsc@hc-sc.gc.ca
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Pour changer votre adresse d'envoi ou numéro de télécopieur, veuillez communiquer avec le détenteur d'autorisation de mise sur le marché (l'industrie).
originale signée par
Cathy Lau, Ph.D.
Vice-présidente, Réglementation et gestion de la qualité
Images
Sélectionner une vignette pour agrandir - ouvre dans une nouvelle fenêtre