Importation de seringues préremplies à dose unique de 1 mg/10 mL d’épinéphrine injectable USP autorisée aux États-Unis en raison de la pénurie actuelle de seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP autorisée au Canada
Résumé
Voir les messages clés ci-dessous
Produits visés
| Nom de marque du produit | Forme posologique, concentration et emballage | Pays d’autorisation et code d’identification | Titulaire de l’autorisation/Fabricant | Importateur au Canada |
|---|---|---|---|---|
| Épinéphrine injectable, USP | Solution pour injection Seringue préremplie Luer-Jet Luer-Lock à dose unique de 1 mg/10 mL (0,1 mg/mL) Pour usage par voie intraveineuse uniquement. | États-Unis d’Amérique NDC : 76329-3318-1 N° de marchandise 3318 | Amphastar Pharmaceuticals, Inc. (É.-U.)/ International Medication Systems, Limited | Amphastar Pharmaceuticals, Inc. (Canada) |
Problème
Compte tenu de la pénurie de seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP au Canada, et afin de maintenir l’approvisionnement, Santé Canada a autorisé l’importation et la vente temporaires exceptionnelles de seringues préremplies à dose unique de 1 mg/10 mL d’épinéphrine injectable USP autorisé aux États-Unis, avec étiquettes en anglais seulement, par Amphastar Pharmaceuticals, Inc.
Destinataires
Professionnels de la santé, y compris pharmaciens, cardiologues, anesthésiologistes, médecins et infirmières en soins intensifs, et médecins et infirmières d’urgence.
Messages clés
- En raison d’une pénurie de seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP au Canada, et compte tenu de l’importance médicale de ce médicament, Santé Canada a permis l’importation et la vente temporaires exceptionnelles de seringues préremplies à dose unique de 1 mg/10 mL d’épinéphrine injectable USP autorisée aux États-Unis, portant des étiquettes en anglais seulement, par Amphastar Pharmaceuticals, Inc.
- Il est conseillé aux professionnels de la santé :
- D’être conscients que le produit autorisé aux États-Unis est étiqueté pour une utilisation intraveineuse seulement. Que, contrairement au produit autorisé au Canada par Pfizer Canada ULC qui est étiqueté pour une utilisation intraveineuse et intracardiaque, le produit autorisé aux États-Unis ne contient pas d’aiguille et n’est pas destiné à l’administration intracardiaque.
- D’être conscients que le produit autorisé aux États-Unis utilise une seringue Luer-JetMC compatible avec la tubulure intraveineuse Luer-Lock.
- D’être conscients qu’il existe des différences entre les ingrédients non médicinaux du produit autorisé aux États-Unis et ceux du produit autorisé au Canada de Pfizer, bien qu’on ne s’attende pas à ce qu’ils soient significatifs sur le plan clinique.
- De consulter l’emballage extérieur du produit autorisé aux États-Unis pour connaître les instructions d’assemblage de la seringue (voir l’Annexe 1) et la monographie canadienne des seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP de Pfizer Canada ULC (DIN 00710814), disponible en anglais et en français dans la base de données sur les produits pharmaceutiques de Santé Canada, pour obtenir d’autres renseignements sur l’utilisation appropriée.
Contexte
Au Canada, l’épinéphrine injectable est utilisée pour soulager la détresse respiratoire causée par un bronchospasme, prendre en charge les réactions d’hypersensibilité, prolonger l’action des anesthésiques locaux, et rétablir le rythme cardiaque pendant un arrêt cardiaque, une crise de bloc cardiaque auriculoventriculaire (A-V) transitoire ou une crise syncopale, entre autres utilisations.
Information à l’intention des professionnels de la santé
Ce produit doit être administré par des professionnels de la santé dûment formés, qui connaissent bien ses actions, ses caractéristiques et ses dangers.
Le produit autorisé aux États-Unis contient le même ingrédient actif (épinéphrine), la même concentration (0,1 mg/mL) et la même forme posologique (solution) que les seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP de Pfizer autorisée au Canada. Cependant, il existe des différences dans la voie d’administration et le système d’administration entre les produits, qui sont importantes à noter, en particulier en cas d’urgence où des injections d’épinéphrine sont couramment utilisées. Ces risques pourraient ne pas être facilement apparents en raison des couleurs d’emballage semblables des produits américains et canadiens. Le bon choix du produit prévu doit être vérifié afin d’éviter toute confusion et prévenir les erreurs.
Les professionnels de la santé doivent savoir que :
- Le produit autorisé aux États-Unis est étiqueté pour une utilisation intraveineuse seulement. Contrairement au produit autorisé au Canada par Pfizer Canada ULC qui est étiqueté pour une utilisation intraveineuse et intracardiaque, le produit autorisé aux États-Unis ne contient pas d’aiguille et n’est pas destiné à l’administration intracardiaque.
- Le produit autorisé aux États-Unis utilise une seringue Luer-JetMC qui est compatible avec la tubulure intraveineuse Luer-Lock, tandis que le produit autorisé au Canada de Pfizer utilise une seringue AbbojectMD, qui comprend une aiguille et permet un accès sans aiguille.
- Il existe des différences entre les ingrédients non médicinaux du produit autorisé aux États-Unis et ceux du produit autorisé au Canada de Pfizer, bien qu’on ne s’attende pas à ce qu’ils soient significatifs sur le plan clinique.
- Il faut consulter l’emballage extérieur du produit autorisé aux États-Unis pour les instructions d’assemblage de la seringue (voir l’Annexe 1) et la monographie canadienne des seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP de Pfizer Canada ULC (DIN 00710814), disponible en anglais et en français dans la Base de données sur les produits pharmaceutiques de Santé Canada, pour obtenir d’autres renseignements sur l’utilisation appropriée.
Les étiquettes du produit autorisé aux États-Unis (voir l’Annexe 1) sont en anglais seulement et ne comprennent aucune information en français.
Les professionnels de la santé peuvent consulter d’autres renseignements sur le produit autorisé aux États-Unis dans les articles suivants :
- Les renseignements posologiques autorisés aux États-Unis les plus récents, disponibles en anglais seulement, accessibles sur le site Web de la Food and Drug Administration des États-Unis : https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=211363.
- Le feuillet d’information inclus avec le produit autorisé aux États-Unis (un feuillet par boîte de 10 emballages), rédigé en anglais seulement. Vous pouvez accéder aux copies numériques complètes du feuillet d’information (en anglais et traduit en français) en cliquant sur le lien suivant: https://amphastar.com/epinephrine-usp-2.html
De plus, le produit autorisé aux États-Unis n’a pas de numéro d’identification de médicament (DIN) ni de code à barres permettant de le numériser dans les systèmes de gestion des médicaments au Canada. Un autocollant généré par l’établissement est recommandé pour permettre la lecture du code à barres et l’identification adéquate du produit distribué et administré.
Mesures prises par Santé Canada
Pour remédier à la pénurie de seringues à usage unique de 1 mg/10 mL d’épinéphrine injectable USP au Canada, Santé Canada a permis l’importation et la vente temporaires exceptionnelles de seringues préremplies à dose unique de 1 mg/10 mL d’épinéphrine injectable USP autorisée aux États-Unis par Amphastar Pharmaceuticals, Inc., et a ajouté ce produit à la Liste des drogues destinées aux importations et aux ventes exceptionnelles.
Santé Canada a travaillé avec Amphastar Pharmaceuticals, Inc. pour préparer cette alerte concernant l’épinéphrine injectable. Santé Canada communique ces renseignements importants sur l’innocuité aux professionnels de la santé et aux Canadiens par l’intermédiaire de la Base de données des rappels et des avis de sécurité sur le site Web Canadiens en santé. Ce communiqué de mise à jour sera distribué par le biais du système de notification par courriel « Avis électronique MedEffetMC ».
Pour signaler un problème lié à la santé ou à l’innocuité
La gestion des effets secondaires liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Tout cas grave d’effet indésirable ou inattendu chez des patients recevant l’épinéphrine injectable doit être signalé à Amphastar Pharmaceuticals, Inc. ou à Santé Canada.
Amphastar Pharmaceuticals, Inc.
2000 Ellesmere Road, Unit 16
Scarborough (Ontario) M1H 2W4
Canada
Téléphone : 1-800-423-4136 ou 1-909-980-9484
Télécopieur : 1 909 980-6422
Pour corriger votre adresse postale ou votre numéro de télécopieur, communiquez avec Amphastar Pharmaceuticals Inc.
Vous pouvez signaler les effets secondaires soupçonnés associés à l’utilisation de produits de santé à Santé Canada:
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirables en ligne, par courrier ou par télécopieur.
Pour toute autre question sur le produit de santé liée à ce communiqué, veuillez communiquer avec Santé Canada à :
Direction générale des opérations réglementaires et de l’application de la loi
Courriel : hpce-cpsal@hc-sc.gc.ca
Téléphone : 1 800 267-9675
Original signé par
Tony Marrs, MSP, MAA
Vice-président exécutif des opérations cliniques
Annexe 1.
A. Image d’Épinéphrine injectable USP autorisé aux États-Unis
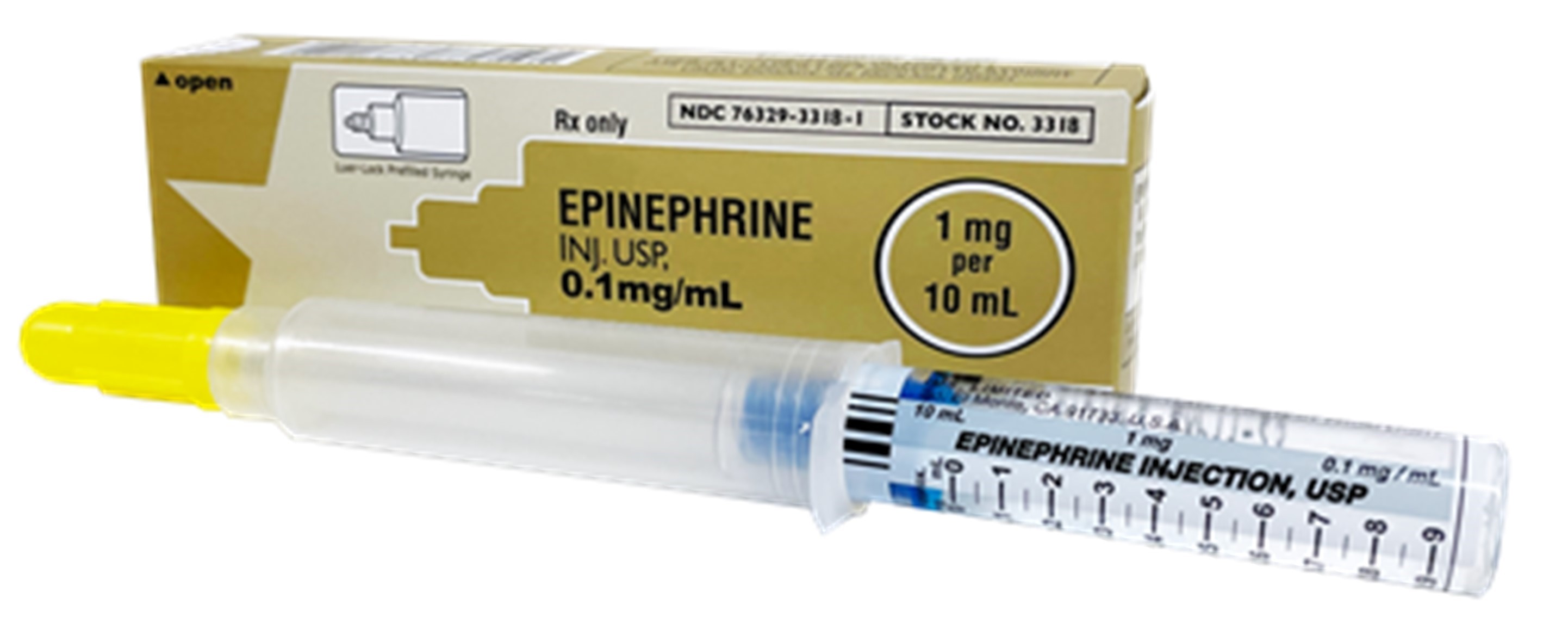
B. Image d’Épinéphrine injectable USP autorisé aux États-Unis, Étiquette intérieure
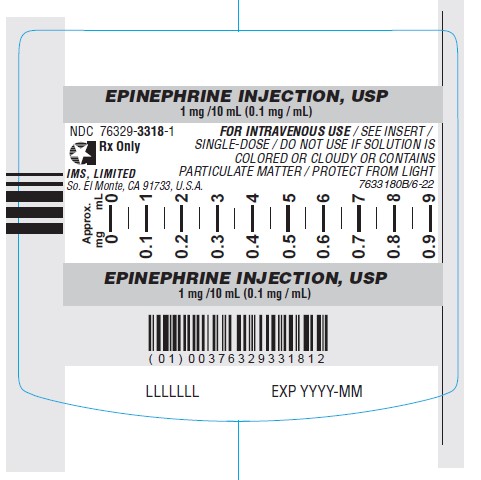
C. Image d’Épinéphrine injectable USP autorisé aux États-Unis, Étiquette extérieure (emballage)

Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des courriels concernant les nouveaux rappels et avis de sécurité, ainsi que leurs mises à jour.