Importation de Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé au Royaume-Uni, en raison d'une pénurie de Chlorure de potassium en solution concentrée pour injection, autorisé au Canada
Résumé
Voir les messages clés ci-dessous
Produits visés
| Nom du produit | Forme posologique, teneur, format d’emballage et voie d'administration | Pays d'origine et code d'identification | Fabricant | Importateur et fournisseur au Canada |
|---|---|---|---|---|
| Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion | Solution concentrée pour perfusion, 150 mg / mL de chlorure de potassium, ampoule en plastique de 10 mL, utilisation intraveineuse | UK PL 24598/0003 | Noridem Enterprises Ltd., Chypre | Juno Pharmaceuticals Corp. |
Problème
Une pénurie de Chlorure de potassium en solution concentrée pour injection sévit actuellement au Canada en raison des perturbations liées à la fabrication des produits. Compte tenu de la nécessité médicale de ce produit et pour aider à atténuer cette pénurie, Santé Canada a autorisé l'importation et la vente exceptionnelles et temporaires de Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé par le Royaume-Uni et dont l'étiquette est en anglais seulement.
Destinataires
Les professionnels de la santé, notamment les pharmaciens hospitaliers, les médecins de soins intensifs, les médecins urgentistes et les médecins hospitaliers.
Messages clés
- En raison d'une pénurie de Chlorure de potassium en solution concentrée pour injection (149 mg / mL) au Canada et compte tenu de la nécessité médicale de ce produit, Santé Canada a autorisé l'importation et la vente exceptionnelles et temporaires de Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé par le Royaume-Uni, avec des étiquettes en anglais seulement, et a ajouté ce produit à la Liste des médicaments pour l’importation et la vente exceptionnelles.
- Les professionnels de la santé sont informés que :
- Le produit autorisé au Royaume-Uni contient le même ingrédient actif, la même concentration, les mêmes excipients et la même forme posologique que les produits de Chlorure de potassium en solution concentrée pour injection autorisés au Canada. Les produits autorisés au Royaume-Uni et autorisés au Canada NE sont PAS destinés à la perfusion directe et doivent être dilués avant la perfusion intraveineuse.
- Malgré la même concentration, la teneur par volume total est exprimée légèrement différemment sur les étiquettes du Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion (150 mg / mL), autorisé au Royaume-Uni, que sur les étiquettes des produits de Chlorure de potassium en solution concentrée pour injection (149 mg / mL) autorisés au Canada.
- Outre les différences d'indications, il existe des différences significatives dans les directives relatives à la préparation, dans la conservation et la stabilité et les étiquettes intérieures et extérieures, et l'emballage, entre les produits de Chlorure de potassium en solution concentrée pour injection (149 mg / mL) commercialisés au Canada et le produit autorisé au Royaume-Uni (voir la section « Information à l’intention des professionnels de la santé »).
Contexte
Au Canada, le Chlorure de potassium en solution concentrée pour injection (149 mg / mL) est indiqué pour le traitement des états de carence en potassium lorsque le traitement de substitution orale n'est pas possible, pour le traitement de l'alcalose hypokaliémique-hypochlorémique et pour la prévention et le traitement de l'hypokaliémie qui peut survenir à la suite de l'administration de diurétiques ou de corticostéroïdes. Il peut également être utilisé dans le traitement des arythmies cardiaques associées à une intoxication par les digitaliques.
Il y a une pénurie de Chlorure de potassium en solution concentrée pour injection au Canada en raison de perturbations liées à la fabrication des produits. Santé Canada permet l'importation temporaire de Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé au Royaume-Uni, afin d'atténuer la pénurie actuelle sur le marché canadien.
Information à l’intention des professionnels de la santé
Le produit autorisé au Royaume-Uni est offert en ampoules de plastique de 10 mL et contient le même ingrédient actif, la même concentration, les mêmes excipients et la même forme posologique que les produits autorisés au Canada. Les produits autorisés au Royaume-Uni et autorisés au Canada ne sont PAS destinés à la perfusion directe et doivent être dilués avant la perfusion intraveineuse.
Bien que la concentration soit la même, la teneur par volume total est exprimée légèrement différemment sur les étiquettes du produit de Chlorure de potassium autorisé au Royaume-Uni (150 mg / mL) que sur les étiquettes des produits de Chlorure de potassium autorisés au Canada (149 mg / mL).
Outre les différences d'indications (voir le tableau 1), il existe des différences essentielles en ce qui concerne les formats d’emballage, les directives relatives à la préparation et les étiquettes intérieures et extérieures.
Tableau 1 : Résumé tabulaire des produits de Chlorure de potassium en solution concentrée pour injection (149 mg / mL), autorisés au Canada, en pénurie et des produits de Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion (150 mg / mL), autorisés au Royaume-Uni, exceptionnellement importés*.
| Chlorure de potassium en solution concentrée pour injection (149 mg / mL) autorisé au Canada – actuellement en pénurie |
Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé au Royaume-Uni |
|||
|
Pfizer Canada ULC No DIN 00037869 |
Omega Laboratories Limited DIN 00402206DIN 02480034 |
B. Braun Medical Inc. No DIN 02485699 |
|
|
| Indication(s) autorisée(s) |
Traitement des états de carence en potassium lorsqu'il n'est pas possible d'administrer un traitement de substitution par voie orale.
|
Il est utilisé dans le traitement de l'alcalose hypokaliémique-hypochlorémique et pour la prévention et le traitement de l'hypokaliémie qui peut survenir à la suite de l'administration de diurétiques ou de corticostéroïdes. Il peut être utilisé dans le traitement des arythmies cardiaques dues à une intoxication par les digitaliques.
|
Traitement des états de carence en potassium lorsqu'il n'est pas possible d'administrer un traitement de substitution par voie orale.
|
La prévention et le traitement des états de carences en potassium lorsqu’il n’est pas possible d'administrer un traitement de substitution par voie orale.
|
| Format(s) d’emballage † |
Fioles à usage unique de 10 mL et 20 mL |
Fioles à usage unique de 10 mL et 20 mL Fiole grand format pour pharmacies de 100 mL |
Sac de 250 mL (emballage grand format pour pharmacies) |
Ampoule en plastique de 10 mL |
* Le produit autorisé au Royaume-Uni est destiné à soutenir la pénurie des produits comparables autorisés au Canada indiqués dans ce tableau, quelles qu’en soient les différences d'indication.
† En raison des différences de format d'emballage entre les produits autorisés au Canada et au Royaume-Uni, les instructions relatives à la préparation diffèrent d'un produit à l'autre.
Les professionnels de la santé sont informés que :
- Il existe des différences significatives entre les étiquettes intérieures et extérieures et l'emballage du produit (150 mg / mL), autorisé au Royaume-Uni (voir l'Annexe 1 pour les images des étiquettes) et les produits autorisés au Canada (149 mg / mL), ce qui peut augmenter le risque d'erreurs de la médication telles que :
- Différence d’emballage : Le fait que le produit autorisé au Royaume-Uni soit fourni sous forme d'ampoule en plastique plutôt que sous forme de fiole ou dans des sacs parentéraux en plastique pourrait augmenter le risque de sélection par inadvertance, car l'ampoule a un aspect similaire à celui d'autres produits également disponibles en ampoules de 10 mL, par exemple, l'eau stérile pour injection ou le chlorure de sodium injectable à 0,9 % (voir le tableau 1).
- Absence de mises en garde critiques : Tous les produits concentrés en potassium fournis dans des fioles ou des ampoules au Canada doivent présenter des caractéristiques distinctives sur l'étiquette et l'emballage, telles que des bouchons noirs et des opercules noirs portant les mots « Doit être dilué » dans une couleur contrastante, ou des bandes noires. L'absence d'affichage distinctif de ces avertissements critiques sur le produit autorisé au Royaume-Uni pourrait accroître le risque d'administration accidentelle du produit par perfusion directe sans dilution.
- Différence dans l'expression de la teneur : L'expression de la concentration en « mEq » est absente alors que l'expression de la concentration en « mmol » est moins visible sur les étiquettes du produit autorisé au Royaume-Uni.
- Différence de la dénomination : Les étiquettes du produit britannique affichent un « K » bien visible. Cet acronyme d'une seule lettre n'est pas une pratique courante pour identifier les produits à base de chlorure de potassium au Canada.
- Le chlorure de potassium en solution concentrée est susceptible de causer de graves dommages s'il est administré par erreur. Pour éviter les erreurs de médication, il convient de s'assurer que le produit médicamenteux utilisé est bien choisi.
- Le Résumé des caractéristiques du produit (SmPC) du Royaume-Uni disponible en anglais, doit être consulté pour les directives relatives à la préparation. Le résumé des caractéristiques du produit britannique (SmPC), traduit en français, est disponible sur le site de junopharm.ca
- Pour le traitement des états de carence en potassium lorsqu'une thérapie de substitution orale n'est pas possible, la monographie de produit canadienne commercialisée, autorisée pour cette indication, doit être utilisée pour les informations sur les indications, les contre-indications, la posologie, l'administration, la conservation et la stabilité, les mises en garde et les précautions, les effets indésirables du médicament et les interactions médicamenteuses.
- Pour le traitement de l'alcalose hypokaliémique-hypochlorémique, la prévention et le traitement de l'hypokaliémie pouvant survenir à la suite de l'administration de diurétiques ou de corticostéroïdes, et le traitement des arythmies cardiaques dues à l'intoxication par les digitaliques, la monographie de produit canadienne commercialisée, autorisée pour cette indication, doit être utilisée pour les informations sur les indications, les contre-indications, la posologie, l'administration, la conservation et la stabilité, les mises en garde et les précautions, les effets indésirables du médicament et les interactions médicamenteuses.
Les hôpitaux doivent savoir que le Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé au Royaume-Uni, n'a pas de numéro d'identification de médicament (DIN) ni de code-barres qui se lisent dans les systèmes de gestion des médicaments au Canada. Un autocollant, généré par l'établissement, pourrait être utile pour permettre la lecture du code-barres et l'identification correcte du produit délivré et administré.
Mesures prises par Santé Canada
Étant donné la nécessité médicale du Chlorure de potassium en solution concentrée pour injection au Canada et pour atténuer la pénurie de ce produit, Santé Canada a autorisé l'importation et la distribution exceptionnelles et temporaires du Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé par le Royaume-Uni, et a ajouté ce produit à la Liste des médicaments pour l’importation et la vente exceptionnelles.
Santé Canada a travaillé avec Juno Pharmaceuticals Corp. pour préparer cette alerte concernant le Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion. Santé Canada communique cette importante information de sécurité aux professionnels de la santé et à la population canadienne par l'entremise de la base de données sur des rappels, des avis et des avis de sécurité du site Internet « Canadiens en santé ». Cette communication sera également diffusée par le biais du système de notification par avis électronique MedEffetMC.
Signaler un problème lié à la santé ou à l’innocuité
La gestion des effets secondaires liés aux produits de santé commercialisés dépend des professionnels de la santé et des consommateurs qui les signalent. Tout cas d'effet secondaire grave ou inattendu chez les patients recevant du Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion doit être signalé à Juno Pharmaceuticals Corp. ou à Santé Canada.
Juno Pharmaceuticals Corp.
2233 Argentia Road 402
Mississauga (Ontario) L5N 2X7
1-855-819-0505
Pour corriger votre adresse postale ou votre numéro de télécopieur, veuillez communiquer avec Juno Pharmaceuticals Corp.
Vous pouvez signaler les effets secondaires soupçonnés associés à l'utilisation de produite de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345 ; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirable en ligne, par la poste ou par télécopieur.
Pour d’autres renseignements concernant les produits de santé reliés à cette communication, veuillez communiquer avec Santé Canada :
Direction générale des opérations réglementaires et de l'application de la loi
Courriel : hpce-cpsal@hc-sc.gc.ca
Téléphone : 1-800-267-9675
Copie originale signée par :
Paul Varady
Annexe 1 - Images de Chlorure de potassium à 15 % p/v en solution concentrée pour perfusion, autorisé au Royaume-Uni avec un étiquetage en anglais uniquement
Photos du produit
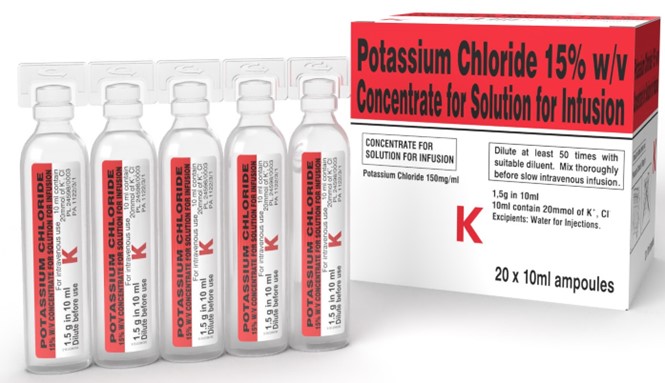
Étiquette de la fiole

CHLORURE DE POTASSIUM À 15 % P/V
EN SOLUTION CONCENTRÉE POUR PERFUSION
Pour usage intraveineux
38246310-5
1,5 g dans 10 mL.
Diluer avant utilisation
K
10 mL contiennent 20 mmol de K+, Cl-
PL 24598/0003
PA 1122/3/1
Étiquette de la boîte
Panneau-avant de la boîte

CHLORURE DE POTASSIUM À 15 % P/V
EN SOLUTION CONCENTRÉE POUR PERFUSION
SOLUTION CONCENTRÉE POUR PERFUSION
Chlorure de potassium 150 mg / mL
Diluer au moins 50 fois avec un diluant approprié. Mélanger soigneusement avant la perfusion intraveineuse lente.
1,5 g dans 10 mL
10 mL contiennent 20 mmol de K+, Cl-
Excipients : Eau pour injection.
K
20 ampoules de 10 mL
Panneau supérieur de la boîte

CHLORURE DE POTASSIUM À 15 % P/V
EN SOLUTION CONCENTRÉE POUR PERFUSION
Chlorure de potassium
150 mg/mL
5208063000233
20 ampoules de 10 mL
K
Doit être dilué avant utilisation.
Panneau-arrière de la boîte

CHLORURE DE POTASSIUM À 15 % P/V
EN SOLUTION CONCENTRÉE POUR PERFUSION
Pour usage intraveineux.
N'utiliser que si les solutions sont claires et exemptes de particules. Lire la notice avant utilisation. Utiliser selon les directives d'un médecin. Jeter après la première utilisation.
K
CONSERVER HORS DE LA VUE ET DE LA PORTÉE DES ENFANTS
Titulaire de l'autorisation de mise en marché
noridem ENTERPRISES LIMITED
Evagorou & Makariou, Mitsi Building 3,
Office 115, 1065 Nicosia, Chypre.
20 ampoules de 10 mL
Panneau latéral gauche de la boîte

CHLORURE DE POTASSIUM À 15 % P/V
EN SOLUTION CONCENTRÉE POUR PERFUSION
Doit être dilué avant utilisation
Chlorure de potassium 150 mg / mL
Après la première ouverture : Du point de vue microbiologique, le produit doit être utilisé immédiatement.
5208063000233
K
POM
PL 24598/0003
PA 1122/3/1
20 ampoules de 10 mL
Panneau latéral droit de la boîte

CHLORURE DE POTASSIUM À 15 % P/V
EN SOLUTION CONCENTRÉE POUR PERFUSION
Doit être dilué avant utilisation
Chlorure de potassium
150 mg/mL
K
20 ampoules de 10 mL
Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des courriels concernant les nouveaux rappels et avis de sécurité, ainsi que leurs mises à jour.