COMIRNATY (vaccin contre la COVID-19, ARNm, aussi appelé Vaccin contre la COVID-19 de Pfizer BioNTech) : nouvelle formulation/présentation destinée aux personnes âgées de 12 ans et plus
Résumé
Voir les messages clés ci-dessous
Produits visés
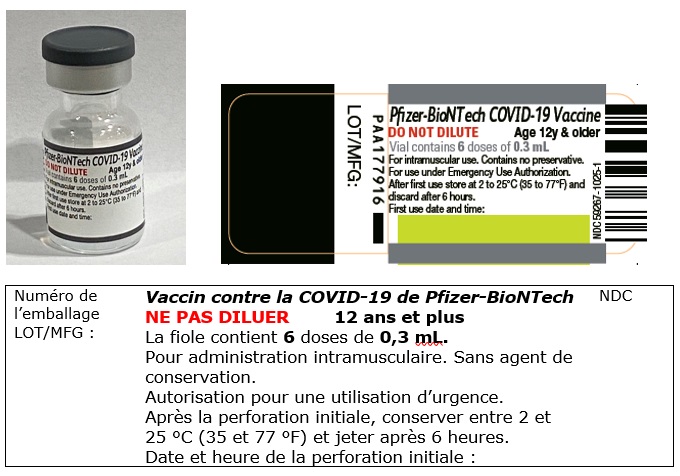
COMIRNATY (vaccin contre la COVID-19, ARNm, aussi appelé Vaccin contre la COVID-19 de Pfizer-BioNTech) destiné aux personnes âgées de 12 ans et plus. Capuchon gris et étiquette à bordure grise – Ne PAS diluer (30 mcg/0,3 mL). Suspension pour injection intramusculaire, fioles multidoses. Chaque fiole contient 6* doses (de 0,3 mL chacune).
[DIN : 02522454]
Problème
INFORMATION MISE À JOUR le 10 juin 2022
Suite à la communication du 9 mai 2022 ci-dessous, Santé Canada a émis un nouveau DIN (DIN 02527863) pour COMIRNATY (vaccin contre la COVID-19, ARNm), 30 mcg/0,3 mL, présenté sous forme de fioles à capuchon GRIS avec étiquette à bordure GRISE.
Chaque présentation de COMIRNATY au Canada porte maintenant un DIN distinct :
- CAPUCHON GRIS et ÉTIQUETTE À BORDURE GRISE (DIN 02527863)
- CAPUCHON VIOLET et ÉTIQUETTE À BORDURE VIOLETTE (DIN 02509210)
- CAPUCHON ORANGE et ÉTIQUETTE À BORDURE ORANGE (DIN 02522454)
Le nouveau DIN aidera à réduire le risque d’erreur de médicament, compte tenu des différentes présentations de COMIRNATY offertes au Canada, en plus d’aider les professionnels de la santé à suivre l’utilisation du produit.
9 mai 2022
Le 16 septembre 2021, un avis de conformité a été émis pour COMIRNATY en vertu du Règlement sur les aliments et drogues, en remplacement de l’autorisation préalable accordée en vertu d’un arrêté d’urgence.
Le 15 mars 2022, COMIRNATY a également reçu un avis de conformité pour une autre formulation/présentation (DIN 02522454) destinée aux personnes âgées de 12 ans et plus. Cette nouvelle formulation/présentation n’exige PAS de dilution.
À titre de mesure exceptionnelle, afin d’offrir un accès plus rapide aux stocks de vaccin dans le contexte de la pandémie mondiale, Pfizer et BioNTech continuent de fournir des stocks de vaccin dans des boîtes et des fioles dont l’étiquette porte le nom Pfizer-BioNTech COVID-19 Vaccine. Sur ces étiquettes unilingues anglaises, il manque des renseignements importants particuliers au Canada qui se trouvent normalement sur les étiquettes approuvées par Santé Canada (voir la section Information à l’intention des professionnels de la santé).
Destinataires
Professionnels de la santé, à savoir médecins infectiologues, pharmaciens, médecins de famille, responsables de la santé publique, infirmières et infirmières praticiennes. Professionnels de la santé des centres de vaccination désignés.
Messages clés
- Le 15 mars 2022, une nouvelle formulation/présentation de COMIRNATY (vaccin contre la COVID‑19, ARNm), 30 mcg/0,3 mL (DIN 02522454), destinée aux personnes âgées de 12 ans et plus, a été homologuée par Santé Canada.
- Cette nouvelle formulation/présentation, dans une fiole munie d’un capuchon GRIS et d’une étiquette à bordure GRISE, n’exige PAS de dilution et est soumise à des conditions de conservation différentes (voir le tableau 1).
- COMIRNATY est maintenant autorisé en trois formulations/ présentations différentes qui sont clairement différenciées par la couleur du capuchon de la fiole et de la bordure de l’étiquette (voir les annexes A, B et C) :
- Chaque formulation/présentation est autorisée pour un groupe d’âge particulier et diffère quant aux exigences liées à la conservation, à la manipulation et à la préparation. Ces différences sont présentées dans le tableau 1 ci-dessous, et il est important d’en prendre note attentivement avant l’emploi. La formulation/présentation et le numéro de lot du vaccin doivent être inscrits dans les dossiers de vaccination des patients et consignés à des fins de signalement d’effets indésirables.
- Lorsqu’ils sont préparés selon leurs instructions respectives, le vaccin COMIRNATY présenté dans la fiole munie d’un capuchon GRIS/d’une étiquette à bordure GRISE et le vaccin COMIRNATY présenté dans la fiole munie d’un capuchon VIOLET/d’une étiquette à bordure VIOLETTE sont interchangeables pour l’administration de la série de vaccination contre la COVID-19 aux personnes âgées de 12 ans et plus.
- Les fioles de COMIRNATY destinées aux personnes âgées de 12 ans et plus (capuchon GRIS/étiquette à bordure GRISE ou capuchon VIOLET/étiquette à bordure VIOLETTE) ne peuvent pas être utilisées pour la préparation des doses destinées à des enfants de 5 ans à moins de 12 ans.
- Bien que le nom commercial du vaccin soit désormais COMIRNATY, le Canada continuera de recevoir des fioles dont l’étiquette indiquera Pfizer-BioNTech COVID-19 Vaccine. Pfizer Canada SRI fournit des stocks de vaccin dont les boîtes et les fioles portent une étiquette unilingue anglaise avec la mention US Emergency Use Authorization afin d’accélérer la distribution à l’échelle mondiale de COMIRNATY.
- Les professionnels de la santé doivent être informés :
- que des renseignements importants particuliers propres au Canada ne figurent pas sur les étiquettes de la fiole et de la boîte (voir la section Information à l’intention des professionnels de la santé);
- que l’étiquetage du produit propre au Canada, à savoir la monographie de produit de COMIRNATY et le matériel de formation sont accessibles sur les sites CVDvaccine.ca/fr ou COMIRNATY.ca, ou en balayant le code QR figurant sur l’étiquette unilingue anglaise de la boîte. Ces renseignements sont également accessibles sur le site Web du gouvernement fédéral à vaccin-covid.canada.ca. La monographie de produit canadienne est également accessible en français et en anglais dans la base de données sur les produits pharmaceutiques de Santé Canada ou sur le site de pfizer.ca.
Contexte
Une nouvelle formulation/présentation de COMIRNATY (30 mcg/0,3 mL, destinée aux personnes âgées de 12 ans et plus) a été homologuée par Santé Canada. Cette nouvelle formulation/présentation n’exige PAS de dilution et est soumise à des conditions de conservation différentes (voir le tableau 1). Les fioles sont pourvues d’un capuchon gris et d’une étiquette à bordure grise.
Compte tenu de l’urgence de santé publique causée par la pandémie actuelle, Santé Canada a autorisé l’importation, la vente et la promotion publicitaire de cette nouvelle formulation/présentation dans des boîtes et des fioles dont les étiquettes sont en anglais seulement pour assurer la distribution actuelle du vaccin à l’échelle mondiale.
Information à l’intention des professionnels de la santé
- CAPUCHON GRIS ET ÉTIQUETTE À BORDURE GRISE
- 30 mcg/0,3 mL – Ne PAS diluer
- Pour les personnes âgées de 12 ans et plus
- CAPUCHON VIOLET ET ÉTIQUETTE À BORDURE VIOLETTE
- CAPUCHON ORANGE ET ÉTIQUETTE À BORDURE ORANGE
IMPORTANT : Chaque formulation/présentation est autorisée pour un groupe d’âge particulier et diffère quant aux exigences liées à la conservation, à la manipulation et à la préparation. Ces différences sont présentées dans le tableau 1 ci-dessous, et il est important d’en prendre note attentivement avant l’emploi. La formulation/présentation et le numéro de lot du vaccin doivent être inscrits dans les dossiers de vaccination des patients et consignés à des fins de signalement d’effets indésirables.
Seules les fioles de COMIRNATY à capuchon orange avec une étiquette à bordure orange sont autorisées pour la préparation des doses destinées à des enfants de 5 ans à moins de 12 ans.
Tableau 1 : Différences importantes entre les trois formulations/ présentations de COMIRNATY (d’après la monographie de produit de COMIRNATY)
Les professionnels de la santé doivent être informés de ce qui suit :
- Les renseignements particuliers au Canada sont accessibles sur les sites CVDvaccine.ca/fr ou COMIRNATY.ca, ou en balayant le code QR figurant sur l’étiquette de la boîte. Ces renseignements sont également accessibles sur le site Web du gouvernement fédéral à vaccin-covid.canada.ca. La monographie canadienne du produit est également accessible en français et en anglais dans la base de données sur les produits pharmaceutiques de Santé Canada ou sur le site de pfizer.ca.
- Les renseignements importants suivants particuliers au Canada ne figurent pas sur les étiquettes de la fiole et de la boîte :
- Afin de fournir les stocks actuels du vaccin, les étiquettes de la fiole et/ou de la boîte comportent les énoncés For use under Emergency Use Authorization. Les renseignements spécifiques destinés aux États-Unis (p. ex., Rx only, NDC) doivent être ignorés, car ils ne sont pas pertinents à l’autorisation canadienne.
- Pour toute question de nature médicale, il faut communiquer avec le Service de l’information pharmaceutique de Pfizer Canada SRI au 1-800-463-6001.
- Pour toute autre question d’ordre général, il faut communiquer avec le Service à la clientèle de Pfizer Canada SRI au 1-833-VAX-COVI (1-833-829-2684) ou par courriel au CanadaCSVaccine@pfizer.com.
Mesures prises par Santé Canada
Santé Canada permet l’utilisation de l’étiquette unilingue anglaise pour une période limitée. Santé Canada a imposé des conditions exigeant que Pfizer Canada SRI fournisse dès que possible des stocks de vaccin portant les étiquettes propres au Canada. Santé Canada a rendu accessible tout l’étiquetage en français et en anglais sur le site Web du gouvernement fédéral vaccin-covid.canada.ca.
Santé Canada communique aux professionnels de la santé et aux Canadiens ces renseignements importants relatifs à l’innocuité par l’intermédiaire de la base de données des rappels et avis de sécurité sur le site Web de Canadiens en santé. Cette communication sera également diffusée au moyen du système de notification d’avis électronique de MedEffetMC, de même que dans les médias sociaux, notamment LinkedIn et Twitter.
Pour signaler un problème lié à la santé ou à l’innocuité
La gestion des effets secondaires liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Tout effet secondaire grave ou imprévu chez les patients recevant COMIRNATY doit être signalé à votre unité de santé locale ou à Pfizer Canada SRI.
17300, autoroute Transcanadienne
www.pfizerdeclarationeffetindesirable.com
Si un patient présente un effet secondaire après avoir reçu un vaccin, veuillez remplir le Formulaire de rapport des effets secondaires suivant l’immunisation (ESSI) approprié à votre province ou territoire (https://www.canada.ca/fr/sante-publique/services/immunisation/declaration-manifestations-cliniques-inhabituelles-suite-immunisation/formulaire.html) et l’envoyer à votre unité de santé locale.
Direction des médicaments biologiques et radiopharmaceutiques
Courriel : brdd.dgo.enquiries@hc-sc.gc.ca
Document original signé par
Vratislav Hadrava, M.D., Ph. D.
Vice-président et directeur médical
1. COMIRNATY (vaccin contre la COVID-19, ARNm) [monographie de produit]. Mayence (Allemagne) : BioNTech Manufacturing GmbH; 2022.
Annexe A
|
COMIRNATY (Vaccin contre la COVID-19 de Pfizer-BioNTech) pour les personnes de 12 ans et plus : capuchon gris/étiquette à bordure grise – Ne PAS diluer
|
FIOLE (capuchon gris et étiquette à bordure grise)


Annexe B
|
COMIRNATY (Vaccin contre la COVID-19 de Pfizer-BioNTech) pour les personnes de 12 ans et plus : capuchon violet/étiquette à bordure violette - DILUER AVANT L’ADMINISTRATION
|
FIOLE (capuchon violet et étiquette à bordure violette)

Annexe C
|
COMIRNATY (Vaccin contre la COVID-19 de Pfizer-BioNTech) pour les enfants de 5 ans à < 12 ans : capuchon orange et étiquette à bordure orange - DILUER AVANT L’ADMINISTRATION
|
FIOLE (capuchon orange et étiquette à bordure orange)

Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des courriels concernant les nouveaux rappels et avis de sécurité, ainsi que leurs mises à jour.