Cette page Web a été archivée dans le Web
L’information dont il est indiqué qu’elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n’est pas assujettie aux normes Web du gouvernement du Canada et elle n’a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivé – Renseignements importants concernant l'innocuité: EPREX (époétine alfa) solution stérile : renseignements thérapeutiques révisés pour les insuffisants rénaux chroniques
- Date de début :
- 13 janvier 2004
- Date d’affichage :
- 15 janvier 2004
- Type de communication :
- Avis aux professionnels de la santé
- Sous-catégorie :
- Biologique/vaccin
- Source :
- Santé Canada
- Problème :
- Nouveaux renseignements en matière d'innocuité
- Public :
- Professionnels de la santé
- Numéro d’identification :
- RA-17000710
La présente est une copie d'une lettre de Janssen-Ortho Inc.
Veuillez communiquer avec la compagnie pour obtenir copie de toute référence, pièce jointe ou annexe.
Renseignements importants au sujet des avis de Santé Canada
RENSEIGNEMENTS IMPORTANTS – CONCERNANT L'INNOCUITÉ EPREX* (époétine alfa) Solution stérile Renseignements thérapeutiques révisés pour les insuffisants rénaux chroniques
Le 13 janvier 2004
Madame,
Monsieur,
Janssen-Ortho Inc., en consultation avec Santé Canada, a modifié les sections suivantes de la monographie d'EPREX (époétine alfa) pour les insuffisants rénaux chroniques : Mises en garde, Effets indésirables, Posologie et mode d'emploi, et Renseignements à l'intention du patient. Les renseignements thérapeutiques pour les autres indications approuvées n'ont pas été modifiés.
Au Canada, EPREX (époétine alfa) est offert en deux préparations contenant chacune un stabilisant différent : une préparation contient du polysorbate 80 (SERINGUES PRÉREMPLIES sans sérum-albumine humaine) et l'autre contient de la sérum-albumine humaine (SAH) (FIOLES À USAGES MULTIPLES contenant de la SAH). Voici, à titre d'information, les modifications apportées à la section Posologie et mode d'emploi des renseignements thérapeutiques pour les insuffisants rénaux :
L'administration de protéines humaines recombinantes par voie sous-cutanée peut accroître le risque d'immunogénicitéNote de bas de page 1.
Préparation d'EPREX contenant de la sérum-albumine humaine :
En présence d'un accès intraveineux (p. ex. patients sous hémodialyse), la préparation d'EPREX contenant de la SAH devrait être administrée par voie intraveineuse.
En l'absence d'un accès intraveineux (p. ex. patients atteints d'insuffisance rénale en prédialyse ou sous dialyse péritonéale), la préparation d'EPREX contenant de la SAH peut être administrée par voie sous-cutanée moyennant évaluation des risques et avantages de cette voie d'administration avant l'instauration du traitement.
Préparation d'EPREX contenant du polysorbate 80 (sans sérum-albumine humaine) : La préparation d'EPREX contenant du polysorbate 80 (sans SAH) devrait être administrée par voie intraveineuse seulement.
L'exemplaire ci-joint des renseignements thérapeutiques met en relief d'autres modifications importantes apportées aux sections Mises en garde et Effets indésirables. Veuillez insérer ces renseignements thérapeutiques révisés dans votre Compendium des produits et spécialités pharmaceutiques (CPS) et les utiliser lorsque vous prescrivez ou distribuez EPREX (époétine alfa). Vous pouvez également consulter la monographie révisée sur le site Web de Janssen-Ortho à http://www.janssen-ortho.com.
En novembre 2001 et en juin 2002, Janssen-Ortho Inc. vous a informé de rares cas postcommercialisation d'érythroblastopénie chronique acquise avec anticorps survenus chez des insuffisants rénaux chroniques après des mois ou des années de traitement par EPREX (époétine alfa) ou d'autres hormones régulatrices de l'érythropoïèse. La grande majorité de ces rapports concernaient des insuffisants rénaux chroniques traités par des seringues préremplies de la préparation EPREX contenant du polysorbate 80 (sans SAH) et administrée par la voie sous-cutanée. Rien n'indique l'existence d'un risque accru d'érythroblastopénie chronique acquise avec anticorps avec des seringues préremplies de la préparation contenant du polysorbate 80 (sans SAH) lorsqu'elle est administrée par la voie intraveineuse.
Rien n'indique non plus l'existence d'un risque accru d'érythroblastopénie chronique acquise avec anticorps avec des fioles à usages multiples de la préparation contenant de la SAH et commercialisée uniquement au Canada, qu'elle soit administrée par la voie intraveineuse ou sous-cutanée.
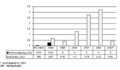
Le taux de notification des cas d'érythroblastopénie chronique acquise avec anticorps a baissé considérablement en 2003 : 5 cas avaient été signalés dans le monde au 31 août 2003. La figure 1 indique les cas d'érythroblastopénie chronique acquise avec anticorps, selon la préparation administrée, qui ont été signalés entre le 1er janvier 1990 et le 31 août 2003.
Figure 1 : Rapports mondiaux de cas d'érythroblastopénie chronique acquise avec anticorps pour 10 000 années-patients, selon la préparation administrée et l'année de perte d'efficacité
Janssen-Ortho Inc. continuera à vous tenir au courant de tout nouveau renseignement scientifique ou médical concernant l'érythroblastopénie chronique acquise. De plus, Santé Canada fournira de l'information supplémentaire concernant l'érythroblastopénie chronique acquise associée à des produits d'érythropoïétine.
L'identification, la caractérisation et la gestion des manifestations indésirables liées à des médicaments dépendent de la participation active des professionnels de la santé aux programmes de notification des effets indésirables des médicaments. On demande aux professionnels de la santé de signaler tous les cas soupçonnés de manifestations indésirables chez des patients prenant EPREX (époétine alfa) à Janssen-Ortho Inc., à l'adresse suivante :
Janssen-Ortho Inc.
Service de la pharmacovigilance
19 Green Belt Drive
Toronto, ON M3C 1L9
1-800-567-3331 (sans frais)
dsscan@joica.jnj.com
En tant que professionnel, vous avez un rôle important à jouer dans la protection du bien-être de vos patients en contribuant au dépistage précoce des effets indésirables et à une utilisation éclairée des médicaments.
Pour obtenir de plus amples renseignements sur l'emploi d'EPREX (époétine alfa), communiquez avec le Service de l'information médicale de Janssen-Ortho Inc. au 1 800 567-3331, du lundi au vendredi entre 9 h et 17 h (HNE).
Cordialement,
originale signée par
Wendy Arnott, Pharm.D.
Vice-présidente
Réglementation, qualité et pharmacovigilance
Tout effet indésirable présumé peut aussi être signalé au :
Programme canadien de surveillance des effets indésirables des médicaments (PCSEIM)
Direction des produits de santé commercialisés
SANTÉ CANADA
Indice de l'adresse 0701C
OTTAWA (Ontario) K1A 0K9
Tél : 613-957-0337 ou télécopieur : 613-957-0335
Lignes sans frais pour les consommateurs et les professionnels de la santé:
Tél: 866-234-2345, Téléc: 866-678-6789
cadrmp@hc-sc.gc.ca
On peut trouver le formulaire de notification des EI et les Lignes directrices concernant des EI sur le site internet de la Direction des produits thérapeutiques ou dans le Compendium des produits et des spécialités pharmaceutiques.
* Tous droits afférents à une marque de commerce sont utilisés en vertu d'une licence
Notes de bas de page
- Note de bas de page 1
-
Porter S. Human Immune Response to Recombinant Human Proteins. J Pharm Sci 2001;90:1-11.
Images
Sélectionner une vignette pour agrandir - ouvre dans une nouvelle fenêtre