Cette page Web a été archivée dans le Web
L’information dont il est indiqué qu’elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n’est pas assujettie aux normes Web du gouvernement du Canada et elle n’a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Vaporisateur sublingual Mylan-Nitro, 0,4 mg par dose prémesurée - Produit non affecté est maintenant disponible - Pour les professionnels de la santé
- Date de début :
- 14 octobre 2014
- Date d’affichage :
- 14 octobre 2014
- Type de communication :
- Avis aux professionnels de la santé
- Sous-catégorie :
- Médicaments
- Source :
- Santé Canada
- Problème :
- Renseignements importants en matière d'innocuité
- Public :
- Professionnels de la santé
- Numéro d’identification :
- RA-41809
La présente est une copie d'une lettre de Mylan Pharmaceuticals ULC. Veuillez communiquer avec la compagnie pour obtenir copie de toute référence, pièce jointe ou annexe.
Renseignements importants au sujet des avis de Santé Canada
Renseignements importants en matière d'innocuité approuvés par Santé Canada concernant le vaporisateur sublingual Mylan-Nitro, 0,4 mg par dose prémesurée
Le 14 octobre 2014
Cher professionnel de la santé,
Objet : Mise à jour - Vaporisateur sublingual Mylan-Nitro, 0,4 mg par dose prémesurée (DIN : 02243588) - du produit non affecté est maintenant disponible
Mylan Pharmaceuticals ULC, en consultation avec Santé Canada, souhaite vous fournir l'information qui suit pour faire suite à la communication qui vous a été transmise en date du 22 septembre 2014, au sujet de la possibilité de pompes défectueuses dans certains lots du vaporisateur sublingual Mylan-Nitro, 0,4 mg/dose prémesurée (DIN : 02243588). Du produit non affecté est maintenant disponible en quantité limitée et sera expédié aux pharmacies et grossistes.
- Les patients qui ont reçu le produit affecté (voir le tableau qui suit) devraient continuer de l'utiliser selon les instructions fournies à cet égard, soit d'utiliser chaque flacon en leur possession jusqu'à environ 70-75 doses (un tiers de son contenu).
- Lorsque chacun des flacons antérieurement distribués aura été utilisé pour 70-75 doses, il devra être remplacé. Au moment du renouvellement de la prescription, on remettra aux patients un flacon de produit non affecté disponible en inventaire.
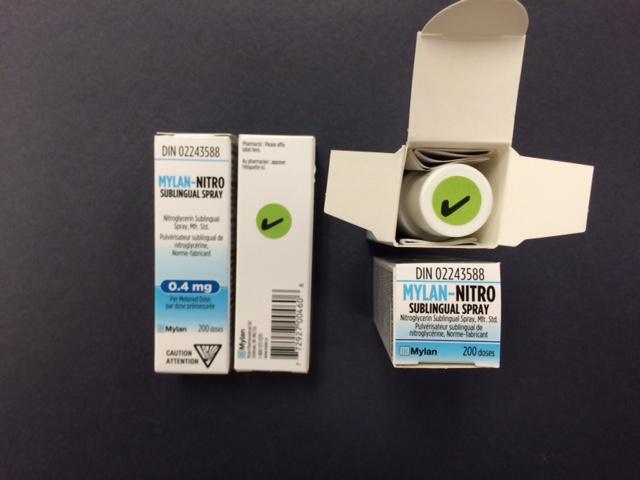
- Les pharmaciens devraient clairement expliquer aux patients que le produit qu'ils reçoivent maintenant n'est pas affecté, tel que l'indiquent les deux étiquettes de vérification apposées (voir la photo ci-dessous), et que le nouveau flacon doit être utilisé au complet, soit pour les 200 doses prescrites qu'il contient.
- Pendant un certain temps, les patients pourraient avoir en leur possession des flacons affectés aussi bien que des flacons non affectés. Les pharmaciens doivent clairement indiquer l'emploi de chacun.
- On doit rappeler aux patients de toujours avoir un flacon en réserve sous la main au cas où leur flacon actuel se trouverait à court de médicament ou qu'il ne fonctionnerait pas correctement.
Ce rappel s'étend aux niveaux pharmacie et grossiste et s'applique uniquement au produit non distribué. Les pharmaciens et professionnels de la santé n'ont pas à contacter les patients pour les aviser de retourner un produit déjà reçu.
| Numéro de lot | Date de péremption (Date d'exp.) |
|---|---|
| 2L734 | Nov-14 |
| 2L731 | Nov-14 |
| 3E830 | Mai-15 |
| 3E828 | Mai-15 |
| 3F834 | Juin-15 |
| 3F837 | Juin-15 |
| 3K873 | Oct-16 |
| 3K877B | Oct-16 |
| 4B948 | Fev-17 |
| 4B949 | Fev-17 |
| 4D973 | Avr-17 |
La distribution de lots de produit affecté doit cesser et tout inventaire existant doit être retourné à Mylan, mais uniquement une fois le produit non affecté reçu. Afin de clairement identifier les lots non affectés, chaque unité de produit non affecté portera deux étiquettes de vérification : une étiquette apposée sur le dessus du bouchon du flacon et une sur le côté de la boite du flacon, telles que démontrées dans la photo suivante.
Le produit libéré pour la distribution par Mylan au cours des douze prochains mois continuera d'être marqué des étiquettes de vérification, afin d'éliminer toute confusion entre le produit précédemment distribué, qui pourrait toujours être utilisé par les patients, et les nouveaux lots de produit non affecté.
Mylan Pharmaceuticals ULC a continué de travailler de façon rigoureuse pour résoudre ce problème le plus rapidement possible et reprendre l'approvisionnement régulier de ce produit.
La gestion des effets indésirables liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Les taux de déclaration calculés à partir des effets indésirables signalés de façon spontanée après la mise en marché des produits de santé sous-estiment généralement les risques associés aux traitements avec ces produits de santé. Tout cas de réaction indésirable grave ou tout autre effet indésirable grave ou imprévu chez les patients recevant le vaporisateur sublingual Mylan-Nitro à 0,4 mg par dose prémesurée doit être signalé à Mylan Pharmaceuticals ULC ou à Santé Canada.
Mylan Pharmaceuticals ULC
85, chemin Advance, Etobicoke, ON
M8Z 2S6
Relations avec le client de Mylan ULC
Téléphone : 1-800-575-1379
Télécopieur : 1-855-236-2990
Courriel : customerservice@mylan.ca
Pour corriger votre adresse d'envoi ou numéro de télécopieur, veuillez communiquer avec Mylan Pharmaceuticals ULC.
Pour déclarer les effets indésirables soupçonnés associés à l'utilisation des produits de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirable en ligne, par courrier ou par télécopieur.
Pour d'autres renseignements concernant les produits de santé reliés à cette communication, veuillez communiquer avec Santé Canada à :
L'Inspectorat de la Direction générale des produits de santé et des aliments
Courriel : DCVIU_UVCEM@hc-sc.gc.ca
Téléphone : 1-800-267-9675
Télécopieur : 613-946-5636
Veuillez agréer mes sincères salutations,
originale signée par
Anca Schmidt
Directrice principale, Qualité
Mylan Pharmaceuticals ULC
Contenu connexe sur les AMR
2014-10-15 | Produits de santé
Images
Sélectionner une vignette pour agrandir - ouvre dans une nouvelle fenêtre