Cette page Web a été archivée dans le Web
L’information dont il est indiqué qu’elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n’est pas assujettie aux normes Web du gouvernement du Canada et elle n’a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Risque potentiel de conséquences graves pour la santé en cas d'administration involontaire de capsules de 1 mg de Cesamet (nabilone) au lieu de comprimés de 50 mg de Trazorel (chlorhydrate de trazodone) dû à une erreur d'étiquetage - Pour les profess...
- Date de début :
- 21 octobre 2009
- Date d’affichage :
- 26 octobre 2009
- Type de communication :
- Avis aux professionnels de la santé
- Sous-catégorie :
- Médicaments
- Source :
- Santé Canada
- Public :
- Professionnels de la santé
- Numéro d’identification :
- RA-170001978
La présente est une copie d'une lettre de Valeant Canada Limitée.
Veuillez communiquer avec la compagnie pour obtenir copie de toute référence, pièce jointe ou annexe.
Renseignements importants au sujet des avis de Santé Canada
Renseignements importants en matière d'innocuité approuvés par Santé Canada concernant les capsules de 1 mg de Cesamet et les comprimés de 50 mg de Trazorel
le 21 octobre 2009
RISQUE POTENTIEL DE CONSÉQUENCES GRAVES POUR LA SANTÉ EN CAS D'ADMINISTRATION INVOLONTAIRE DE CAPSULES DE 1 mg DE CESAMET (nabilone) AU LIEU DE COMPRIMÉS DE 50 mg DE TRAZOREL (chlorhydrate de trazodone) DÛ À UNE ERREUR D'ÉTIQUETAGE
Objet : URGENT - AVIS DE RAPPEL DE PRODUIT DE TYPE I
Avis aux professionnels de la santé :
| Produit | Force | DIN | Type d'emballage | Numéros de lot pour les deux produits |
|---|---|---|---|---|
| CESAMET | 1 mg | 00548375 | Bouteilles de 50 capsules |
9D9875 Date d'expiration : 2011-03 9E0077 Date d'expiration : 2011-05 9G0282 Date d'expiration : 2011-05 9G0283 Date d'expiration : 2011-07 9G0362 Date d'expiration : 2011-08 |
| TRAZOREL | 50 mg | 02230284 | Bouteilles de 100 comprimés |
NCESAMET® (nabilone) est un cannabinoïde synthétique aux propriétés antiémétiques. Son efficacité à soulager certains patients de la nausée et du vomissement liés à la chimiothérapie anticancéreuse a été démontréeNote de bas de page1. Trazorel (chlorhydrate de trazodone) est un composé psychoactif possédant des propriétés sédatives et antidépressives. Il est indiqué dans le soulagement symptomatique de la dépressionNote de bas de page2.
Une étiquette de COMPRIMÉS DE 50 mg DE TRAZOREL a été apposée par erreur sur une bouteille contenant des CAPSULES DE 1 mg DE CESAMET et portant l'un des numéros de lot et l'une des dates d'expiration indiqués dans le tableau susmentionné.
Pour cette raison, Valeant Canada ltée en consultation avec Santé Canada informe les professionnels de la santé d'un rappel concernant les capsules de 1 mg de CESAMET (bouteilles de 50 capsules) et les comprimés de 50 mg de TRAZOREL (bouteilles de 100 comprimés) dont les numéros de lot et les dates d'expiration sont indiqués plus haut.
Un avis semblable a été envoyé à tous les distributeurs de Valeant Canada ltée.
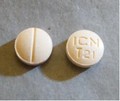
Les patients prenant l'un ou l'autre de ces médicaments ont reçu la description et des images des deux produits en question par l'intermédiaire d'un avertissement public. On leur demande de vérifier immédiatement leurs bouteilles d'ordonnance pour s'assurer qu'elles contiennent le bon produit. Dans le cas contraire, on leur demande de communiquer immédiatement avec leur médecin traitant et de rapporter le produit à la pharmacie. Trazorel est un comprimé de forme ronde, de couleur pêche et marqué de la mention « ICN T21 ». Cesamet est vendu en capsules bleues et blanches marquées du nombre 3101 dans la partie blanche et du logo « ICN » dans la partie bleue. Des photographies des deux produits sont reproduites à la dernière page de la présente lettre.
Les actions suivantes sont recommandées :
- Les pharmaciens sont priés de communiquer avec tout patient auquel ils auraient préparé du Cesamet ou du Trazorel provenant de ces lots dans le but de confirmer l'apparence du produit dans leurs bouteilles et de s'assurer que les patients ont bien reçu le bon produit. En cas de doute, les pharmaciens devraient demander au patient d'apporter le produit à la pharmacie pour vérification.
- Si le moindre doute persiste ou si le patient a reçu un produit par erreur, ce patient doit en informer son professionnel de la santé immédiatement.
- Les médecins sont priés de demeurer disponibles pour les patients qui communiqueront avec eux pour ces raisons.
Les principaux risques médicaux de la prise involontaire du nabilone au lieu du trazodone sont les suivants :
- La dose d'entretien quotidienne habituelle du trazodone est de 300 mg répartie en deux ou trois doses par jour. À cause de l'erreur d'étiquetage, le patient risque de prendre six capsules de 1 mg de nabilone (en croyant qu'il s'agit de trazodone) pour un total de 6 mg par jour au lieu de six comprimés de 50 mg de trazodone répartis en deux ou trois doses par jour. La dose quotidienne maximale de nabilone recommandée est de 6 mg en doses fractionnées (deux fois par jour). Le traitement au nabilone exige un réglage posologique pour des raisons de réponse et de tolérance chez les patients. Des symptômes de surdose, tels que des hallucinations, de l'anxiété et une dépression respiratoire, peuvent apparaître si un patient est exposé de façon aiguë à 6 mg de nabilone en doses fractionnées sans réglage posologique. En outre, une exposition accidentelle à nabilone 6 mg augmente le risque de développer des réactions pouvant durer entre 48 et 72 heures après l'arrêt du traitement.
- Les effets secondaires au nabilone les plus fréquents sont les suivants : somnolence, vertige, euphorie, sécheresse de la bouche, dépression, ataxie, vision brouillée et dysesthésie. Un patient dépressif qui prend le nabilone au lieu de son traitement aux antidépresseurs habituel peut devenir encore plus dépressif étant donné le risque de dépression associé au nabilone.
- Le nabilone est contre-indiqué pour les patients sensibles aux cannabinoïdes ou ayant des antécédents de réactions psychotiques.
Déclaration d'effets secondaires
La gestion des effets indésirables liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Les taux de déclaration calculés à partir des effets indésirables signalés de façon spontanée après commercialisation des produits de santé sous-estiment généralement les risques associés aux traitements avec ces produits de santé. Tout cas d'effet indésirable grave ou imprévu chez les patients recevant un médicament appartenant à l'un des numéros de lot mentionnés dans le tableau doit être signalé à Valeant Canada ltée ou à Santé Canada, aux adresses suivantes :
Valeant Canada ltée
4787, rue Levy
Montréal (Québec) H4R 2P9
Numéro sans frais : 1 800 361-4261
Tout effet indésirable présumé peut aussi être déclaré au :
Programme Canada Vigilance
Direction des produits de santé commercialisés
SANTÉ CANADA
Indice de l'adresse : 0701D
Ottawa (Ontario) K1A 0K9
Téléphone : 613-957-0337 ou télécopieur : 613-957-0335
Pour déclarer un effet indésirable, les consommateurs et les professionnels de la santé peuvent composer ces lignes sans frais :
Téléphone : 866-234-2345 ou télécopieur : 866-678-6789
CanadaVigilance@hc-sc.gc.ca
On peut trouver le formulaire de notification des effets indésirables et les Lignes directrices concernant des effets indésirables sur le site Web de Santé Canada ou dans le Compendium des produits et des spécialités pharmaceutiques.
Pour d'autres renseignements reliés à cette communication, veuillez communiquer avec Santé Canada à :
Inspectorat de la Direction générale des produits de santé et des aliments
Courriel : DCVIU_UVCEM@hc-sc.gc.ca
Téléphone : 1-800-267-9675
Télécopieur : 1-613-946-5636
originale signée par
Mirela Baranci, M.D.
Directrice, Médical et Affaires réglementaires
Valeant Canada ltée
Références
Notes de bas de page
- Note de bas de page 1
-
Cesamet, Monographie de produit canadien, 17 mars 2009, p. 2.
- Note de bas de page 2
-
Trazorel, Monographie de produit canadien, révisée le 23 mars 2009, p. 2-3.
Images
Sélectionner une vignette pour agrandir - ouvre dans une nouvelle fenêtre