Renseignements importants en matière d’innocuité concernant l’importation de Marcaïne-adrénaline à 5 mg/mL et 5 mcg/mL autorisée au Danemark en raison de la pénurie actuelle de SENSORCAINE avec épinéphrine à 5 mg/mL et 5 mcg/mL autorisé au Canada
Résumé
Voir les messages clés ci-dessous
Produits visés
l’importation de Marcaïne-adrénaline à autorisée au Danemark
| Nom de marque du produit | Formes posologiques, concentration, et format de l’emballage | Pays d’autorisation et Code d’identification | Fabricant | Importateur au Canada |
|---|---|---|---|---|
| Marcaïne – adrénaline (chlorhydrate de bupivacaïne et adrénaline [tartrate d’adrénaline]) | Solution injectable 5 mg/mL et 5 mcg/mL Fioles de 20 mL à usage unique Sans agent de conservation | Danemark 10213 | Aspen Pharma Trading Limited, Irlande | Aspen Pharmacare Canada Inc. |
Problème
En raison d’une pénurie critique de SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne à 5 mg/mL et épinéphrine (bitartrate d’épinéphrine) à 5 mcg/mL), et pour assurer la continuité des approvisionnements au Canada, Santé Canada a autorisé l’importation et la vente exceptionnelles et temporaires de Marcaïne-adrénaline (chlorhydrate de bupivacaïne à 5 mg/mL et adrénaline (tartrate d’adrénaline) à 5 mcg/mL) autorisé au Danemark avec étiquettes uniquement en danois par Aspen Pharmacare Canada Inc.
Destinataires
Professionnels de la santé y compris, pharmaciens, anesthésistes, médecins en soins intensifs, médecins urgentistes et ceux qui sont impliqués dans l’administration d’anesthésie.
Messages clés
- En raison d’une pénurie critique de SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne à 5 mg/mL et épinéphrine (bitartrate d’épinéphrine) à 5 mcg/mL) au Canada et étant donné l’importance médicale de cet anesthésique local, Santé Canada a permis l’importation et la vente exceptionnelles et temporaires de Marcaïne-adrénaline (chlorhydrate de bupivacaïne à 5 mg/mL et adrénaline (tartrate d’adrénaline) à 5 mcg/mL) autorisé au Danemark avec étiquettes uniquement en danois par Aspen Pharmacare Canada Inc.
- On avise les professionnels de la santé :
- D’être conscients qu’il y a d’importantes différences dans l’étiquetage du produit entre le produit autorisé au Danemark et le produit autorisé au Canada (voir la section Renseignements pour les professionnels de la santé et le Tableau 1).
- De consulter la monographie de produit canadienne pour SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne à 5 mg/mL et épinéphrine (bitartrate d’épinéphrine) à 5 mcg/mL) par Aspen Pharmacare Canada Inc., disponible en anglais et en français sur la Base de données sur les produits pharmaceutiques : Accéder à la base de données, pour l’information sur l’utilisation appropriée.
Contexte
Au Canada, SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne et épinéphrine) est indiqué pour la production d’une analgésie ou d’une anesthésie locale ou régionale en vue des interventions suivantes :
- infiltration locale;
- blocs des nerfs majeurs ou mineurs périphériques;
- bloc péridural en vue d’une chirurgie;
- bloc péridural par perfusion continue ou bolus intermittent pour le soulagement des douleurs postopératoires ou des douleurs de l'accouchement (travail).
On doit utiliser les techniques habituelles pour l'infiltration locale, le bloc des nerfs mineurs et majeurs, le bloc rétrobulbaire et le bloc péridural.
Information à l’intention des professionnels de la santé
Ce produit devrait être administré par des professionnels de la santé qui ont suivi une formation adéquate et qui sont familiers avec les actions, les caractéristiques et les risques qui y sont associés.
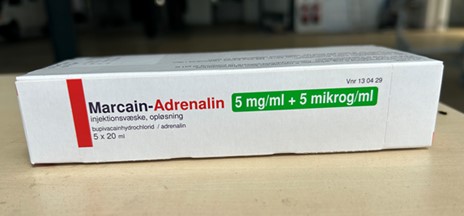
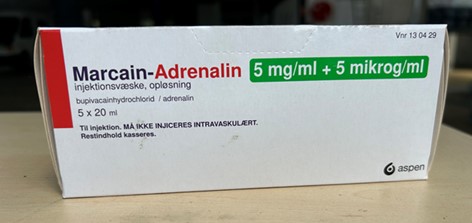
Le produit autorisé au Danemark contient les mêmes ingrédients actifs, concentrations et forme posologique que le produit autorisé au Canada, soit SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne à 5 mg/mL et épinéphrine (bitartrate d’épinéphrine) à 5 mcg/mL). Le produit autorisé au Danemark et le produit autorisé au Canada sont tous deux présentés dans les mêmes fioles de 20 mL à usage unique (voir l’Annexe 1). Toutefois, il y a des différences dans l’étiquetage entre le produit danois autorisé et le produit canadien autorisé, y compris le nom du produit et les différences dans l’expression de la concentration, ce qui peut poser un risque de préjudice significatif pour le patient si des erreurs de posologie ou de sélection de produit surviennent.
- Les étiquettes du produit et l’information sur le produit autorisé au Danemark utilisent le terme « tartrate d’adrénaline » pour un des ingrédients actifs, tandis que « bitartrate d’épinéphrine » est le terme utilisé sur l’étiquette du produit canadien. Le bitartrate d’épinéphrine et le tartrate d’adrénaline sont des substances identiques; la seule différence est la convention d’appellation utilisée.
- Malgré le fait que la concentration soit la même, l’expression de la teneur pour la bupivacaïne est listée différemment sur les étiquettes du produit danois autorisé. Il n’y a aucune expression de pourcentage de teneur (c.-à-d., 0,5 %) ou de quantité totale par volume total (c.-à-d., 100 mg/20 mL) sur les étiquettes du produit danois autorisé.
- Sur les étiquettes du produit autorisé au Danemark, adrénaline (épinéphrine) est listée en mikrog/ml, plutôt qu’en mcg/mL et le rapport (c.-à-d., 1: 200,000) est absent.
- Les étiquettes du produit danois autorisé n’identifient pas le produit comme étant une fiole stérile à usage unique.
- La déclaration de précautions, « Ne pas utiliser si la solution est colorée ou contient un précipité », qui apparaît sur l’étiquette du produit autorisé au Canada, ne se retrouve pas sur l’étiquette du produit autorisé au Danemark.
Le produit autorisé au Danemark ne possède pas de numéro d’identification du médicament (DIN) ni de code-barres pour le numériser dans les systèmes de gestion des médicaments au Canada. Un autocollant généré par l’établissement est recommandé pour permettre la numérisation d’un code-barres et permettre l’identification appropriée du produit distribué et administré.
Tableau 1 : Différences d’étiquetage entre Marcaïne-adrénaline autorisé au Danemark et SENSORCAINE avec épinéphrine autorisé au Canada
| Produit médicamenteux pour importation | Produit médicamenteux canadien | ||
|
Nom de marque du produit |
Marcaïne – adrénaline |
SENSORCAINE avec épinéphrine |
|
| Forme posologique | Solution pour injection | Solution pour bloc/infiltration, péridural | |
| Expression de la concentration | Chlorhydrate de bupivacaïne, 5 mg/mL | 0,5 % de chlorhydrate de bupivacaïne 100 mg/20 mL (5 mg/mL) | |
| adrénaline (tartrate d’adrénaline), 5 mikrog/mL | épinéphrine (bitartrate d’épinéphrine) 1:200,000, 100 mcg/20 mL (5 mcg/mL) | ||
| Code identifiant | 10213 | DIN 01976206 | |
| Format d’emballage | 5 x fioles de 20 mL |
|
|
| Langue d’étiquetage | Danois |
|
Les professionnels de la santé sont avisés que :
- Le produit autorisé au Danemark doit être utilisé de la même façon que le produit autorisé au Canada.
- La monographie de produit canadienne pour SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne à 5 mg/mL et épinéphrine (bitartrate d’épinéphrine) à 5 mcg/mL), par Aspen Pharmacare Canada Inc., disponible en anglais et en français sur la Base de données sur les produits pharmaceutiques : Accéder à la base de données, devrait être consultée pour l’information sur l’utilisation appropriée.
- Vous trouverez plus d’information sur le produit autorisé au Danemark dans la traduction anglaise et française du Résumé des caractéristiques du produit pour Marcaïne – adrénaline, disponible sur www.aspenpharma.ca.
Mesures prises par Santé Canada
Pour aider à atténuer les effets de la pénurie critique de SENSORCAINE avec épinéphrine (chlorhydrate de bupivacaïne et épinéphrine) au Canada, Santé Canada a permis l’importation et la vente exceptionnelles et temporaires de Marcaïne-adrénaline (chlorhydrate de bupivacaïne et adrénaline) autorisé au Danemark par Aspen Pharmacare Canada Inc. et a ajouté ce produit à la Liste des drogues destinées aux importations et aux ventes exceptionnelles.
Santé Canada a travaillé avec Aspen Pharmacare Canada Inc. pour préparer cette alerte pour SENSORCAINE avec épinéphrine. Santé Canada communique ces renseignements importants en matière d’innocuité aux professionnels de la santé et aux Canadiens par le biais de la base de données des Rappels et avis de sécurité sur le site web des Canadiens en santé. Cette mise à jour de la communication sera également distribuée par le biais du système de notification par courriel MedEffect™ e-Notice.
Pour signaler un problème lié à la santé ou à l’innocuité
La gestion des effets secondaires liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Tout cas grave d’effet indésirable ou tout effet indésirable grave ou imprévu chez les patients recevant Marcaïne – adrénaline devrait être signalé à Aspen Pharmacare Canada Inc. ou à Santé Canada.
Aspen Pharmacare Canada Inc.
Unité 8, 1155 North Service Road W.
Oakville, ON, L6M 3E3
Téléphone : 1-844-330-1213
Télécopieur : 1-437-800-4554
Pour corriger votre adresse postale ou numéro de télécopieur, veuillez communiquer avec Aspen Pharmacare Canada Inc.
Vous pouvez signaler les effets secondaires soupçonnés associés à l’utilisation de produits de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirable en ligne, par courrier ou par télécopieur.
Pour d’autres renseignements concernant les produits de santé reliés à cette communication, veuillez communiquer avec Santé Canada :
Direction générale des opérations réglementaires et de l’application de la loi
Courriel : hpce-cpsal@hc-sc.gc.ca
Téléphone : 1-800-267-9675
Annexe 1.
A. Image(s) de Marcaïne-adrénaline avec étiquetage uniquement en danois.
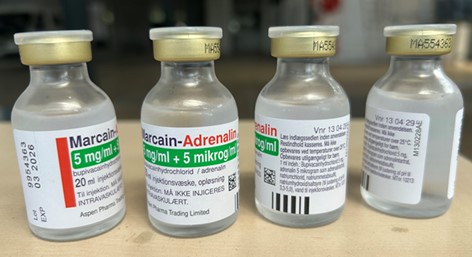


B. Étiquette des fioles Marcaïne – adrénaline

C. Étiquette de la boîte de Marcaïne – adrénaline
D. Maquette du feuillet pour Marcaïne – adrénaline (traduit en FR) :


Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des courriels concernant les nouveaux rappels et avis de sécurité, ainsi que leurs mises à jour.